Co je reakční kinetika?
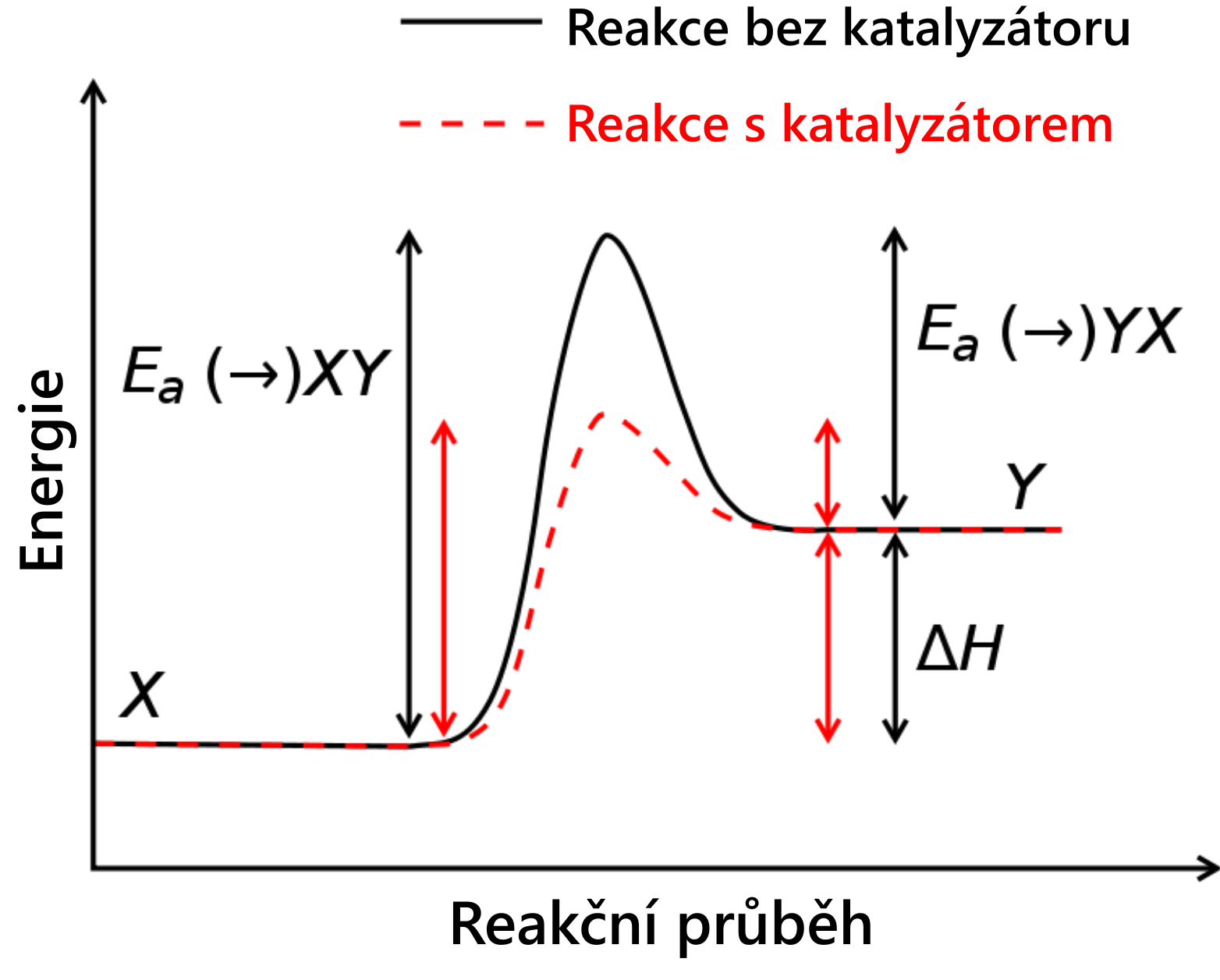
Co je to aktivační energie
Aktivační energie je minimální energie, kterou musí mít částice reagujících látek, aby při jejich srážce mohlo dojít k chemické reakci. Zjednodušeně je to energie potřebná k zahájení chemické reakce. Nejčastěji se značí Ea a její jednotkou je kJ/mol.
Co je to reakce
Reakce představuje odezvu na určitou událost. Může být: chemie (obecná)
Co je to Reaktant
Reaktant je látka nebo látky, které vstupují do chemické reakce a mění se na produkt nebo produkty. Během reakce se reaktanty spotřebovávají. Reaktantem mohou být prvky nebo chemické sloučeniny. V biochemii, zejména v souvislosti s enzymatickými reakcemi, se reaktanty běžně nazývají substráty.
Jak vyjádříme chemickou reakcí
Chemické reakce popisujeme pomocí chemických rovnic.
Na čem závisí rychlost reakce
Rychlost reakce zpravidla závisí na koncentraci reaktantů. Závislost reakční rychlosti na koncentraci reaktantů zjištěná z experimentálních dat je vyjádřena kinetickou rovnicí. Obecný tvar kinetické rovnice je v = k [A]a [B]b.
Jak zpomalit reakcí
– zvýšením teploty se reakce urychlují, snížením teploty zpomalují – zvýšením koncentrace výchozích látek se reakce urychlují, snížením koncentrace výchozích látek se reakce zpomalují.
Co je to rychlostní konstanta
Konstanta úměrnosti k – rychlostní konstanta – je číselně rovna rychlosti reakce při jednotkových koncentracích výchozích látek. Je tedy vhodnou kinetickou veličinou pro porovnávání rychlostí jednotlivých reakcí – čím je větší, tím rychleji reakce probíhá.
Co to je oxidace a redukce
Oxidace je děj, při kterém dochází ke zvyšování oxidačního čísla prvku. Oxidovaný prvek odevzdává elektrony jinému atomu. Redukce je děj, při kterém dochází ke snižování oxidačního čísla prvku. Redukovaný prvek přijímá elektrony od jiného atomu.
Co popisuje Le Chatelierův princip
Le Chatelierův princip
Rovnovážná konstanta K nám popisuje rovnováhu daného chemického systému „reaktanty + produkty“ a při dané teplotě a tlaku bude mít vždy stejnou hodnotu.
Co to je fyzikální dej
Fyzikální děj je děj, při kterém se látka nemění (nevzniká nová látka). např. změna skupenství látek, rozpustnost látek, tání látek …. Přeměny skupenství látek nejsou chemické děje.
Jak vypočítat reakční teplo
Reakční teplo ze spalných tepel se vypočítá jako součet spalných tepel reaktantů (vynásobených stechiometrickými koeficienty), od kterých jsou odečtena spalná tepla produktů (též vynásobená příslušnými koeficienty). Reakční teplo reakce je -52 kJ⋅mol−1.
Jak se změní rychlost reakce
Závislost koncentrace výchozích látek na rychlost chemické reakce je charakterizována Guldberg-Waagovým zákonem: Rychlost chemických reakcí je přímo úměrná koncentraci výchozích látek (eduktů). Z tohoto vztahu vyplývá, že chemická reakce probíhá tím rychleji, čím jsou edukty koncentrovanější.
Jak urychlit reakcí
Z naznačených vztahů je zřejmé, že reakční rychlost lze zvýšit (průběh reakce urychlit) několika cestami: -zvýšením koncentrace výchozích látek, – zvýšením teploty, – změnou reakčního mechanismu, uskutečněním jiné reakční cesty.
Jaká je reakční doba
Celková reakční doba pak závisí na úhlu zaměření pohledu a pohybuje se od zhruba 0,4 do 1,5 s. Průměrná reakční doba přes pedál je 1,2 s a přes volant 0,9 s. U trénovaných řidičů může být nižší a naopak u rozptylovaných řidičů vyšší. Rozptylovat může telefonování, psaní zpráv, hudba a jiné příčiny.
Jak funguje oxidace
Oxidace je ztráta elektronů, případně zvýšení oxidačního čísla příslušného prvku. Odebrané elektrony musí skončit na jiném prvku, a proto je oxidace jedné látky vždy spojena s redukcí látky jiné. Slovo „oxidace“ pochází ze slova „oxid“, které označuje sloučeninu obsahující kyslík.
Co se děje s elektrony při oxidaci
Kdykoliv se nějaká částice (atom, molekula, ion) oxiduje, odevzdává elektrony a zvyšuje své oxidační číslo. Naopak při redukci částice elektrony přijímá a její oxidační číslo se snižuje. Oxidace a redukce tedy probíhá vždy současně, zatímco jedna látka elektrony odevzdává, druhá je přijímá.
Jak určit rád reakce
Řád reakce je číslo, které určuje, jakým způsobem závisí rychlost na koncentraci. Určujeme řády dílčí vždy vůči jen některým reaktantům a řád celkový, který je součtem všech dílčích řádů vůči jednotlivým reaktantům.
Jaký je rozdíl mezi fyzikálním a chemickým dějem
Chemický děj je děj, při kterém se látka mění (vzniká nová látka). např. karamelizace cukru, tlení trávy, kažení potravin, hoření látek …. Fyzikální děj je děj, při kterém se látka nemění (nevzniká nová látka).
Co to je chemický Dej
Chemický děj. je děj, při kterém z výchozích chemických látek vznikají jiné chemické látky s jinými vlastnostmi.
Co to je reakční teplo
Reakční teplo se vyjadřuje pomocí veličiny enthalpie. Je to teplo, které soustava přijme či uvolní za stálého tlaku a teploty při jednotkovém látkovém rozsahu reakce. Absolutní hodnotu nelze změřit, lze pouze stanovit změnu enthalpie ΔH, která je vyjadřována za standardních podmínek (t = 25 °C, p = 101,325 kPa).
Co to je entalpie
Entalpie je fyzikální veličina udávaná v joulech. Entalpie vyjadřuje energii uloženou v termodynamickém systému. Jedná se o jeden ze čtyř základních termodynamických potenciálů. O entalpii hovoříme v souvislosti s rekuperací, když pracujeme s teplem i vlhkostí.
Na jaký podnět člověk reaguje nejrychleji
Tyto typy podnětů bývají rozdělovány na taktilní (dotykové), akustické a vizuální (Lehnert 2010). Nejrychlejších reakčních časů bývá dosaženo při reakci na taktilní podnět, středních hodnot bývá dosaženo při reakci na sluchový podnět a nejdelší reakční časy bývají naměřeny při reakci na vizuální podnět.
Na který z podnětů má člověk nejkratší reakční dobu
Nejkratší reakční doba je na taktilní podnět a z hlediska složitosti na podnět jednoduchý. Nejdelší reakční doba na podnět vizuální a složité podněty při složitých typech odpovědí (např. ve sportovních hrách).
Co se děje při oxidaci
oxidace = dehydrogenace – látka ztrácí vodíkové atomy (buď za přítomnosti kyslíku nebo bez něj) redukce = hydrogenace – látka přijímá vodíkové atomy.
Co vzniká při oxidaci
Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje. Při redukci látka elektrony přijímá a její oxidační číslo se snižuje. Můžeme pozorovat oxidaci vodíku. Celkem čtyři atomy vodíku uvolňují každý po jednom elektronu.



